发布时间:2021-05-08 10:05:36 文章来源:
2021年4月,全球批准新药数量有所上升,国内新批准上市药品均为仿制药品,仿制药一致性评价工作稳定开展。FDA共批准5款新药,包含2款新分子实体药物,2款细胞疗法药物;EMA批准了2款新药;其中Jemperli在FDA与EMA均获批上市用于复发或晚期dMMR子宫内膜癌的治疗。国内医疗器械获批最多的是体外诊断试剂,占比达30.9%。
全球药品获批情况
(一)美国FDA批准情况
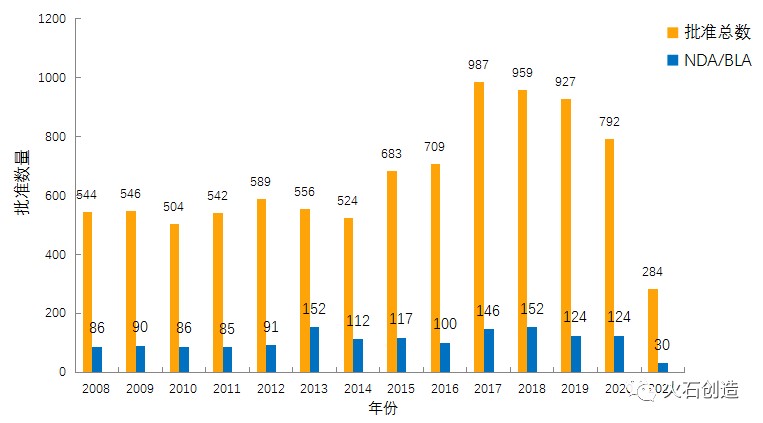
图1:2010—2021年FDA药物批准数量变化情况 来源:美国食品药品监督管理局
如图1,截至2021年5月6日,FDA官网披露,2021年4月FDA共完成59项药品首次批准(不包含暂时批准),其中NDA/BLA批准5个(不包含暂时批准)。其中包括2款新获批的新分子实体药物,另外还有2款细胞疗法药物获得上市批准。

表1:2021年4月FDA批准NDA/BLA药物列表 来源:美国食品药品监督管理局
(二)欧盟EMA批准情况
截至2021年5月6日EMA官网披露,2021年4月批准上市药品共计3个,其中新活性物质(New active substance,NAS)1个。2010年至2021年的批准情况见图2。
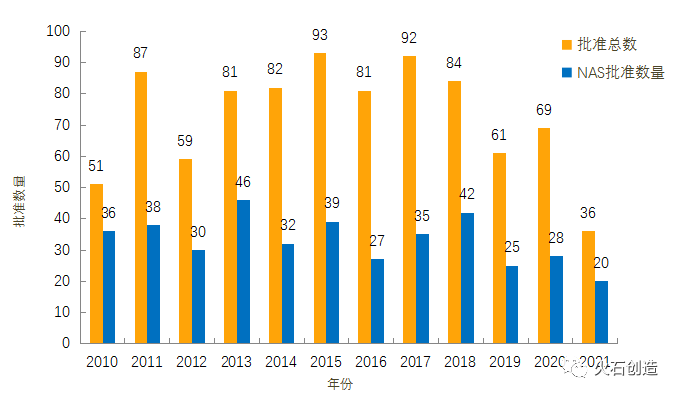
图2:2010—2021年EMA药物批准数量变化情况 来源:欧洲药品管理局
截至2021年5月6日NMPA披露,2021年4月共批准国产首次注册药品84件。按剂型去重后,共69个药品品种,均为仿制药品,其中10款首仿上市药品,包含酒石酸伐兰克尼、托吡酯片等多个年销售额过亿的重磅产品。随着政策的利好,药企在布局创新药研发的同时,首仿药物的研发也是发展方向之一。
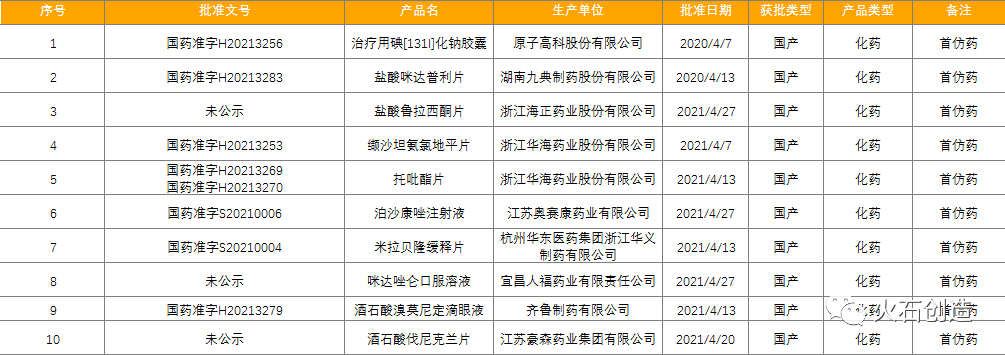
表3:2021年04月NMPA批准首仿药物列表 来源:国家药品监督管理总局
(四)仿制药一致性评价情况
截至2021年5月6日CDE官网披露,共承办药品一致性评价2960个受理号,本月共新增60个受理号获承办。截至2021年5月6日,共2593个品规上市药品通过一致性评价(包含视同通过1187个品规),本月共175个品规药品通过一致性评价药品(包含视同通过78个品规)。按剂型去重后,134个药品品种,其中包含30个品规的药品为首家过评。
本月过评药品中共计79个品规(54个品种)的注射剂型,2021年4月27日,其中包含头孢他啶,头孢曲松等年销售额均超20亿元的重磅抗生素产品,本月均有多家企业过评。随着第五批集采日期临近,预计注射剂型被纳入集采数量将创新高,注射剂型品种的一致性评价竞争将愈发激烈。2020年至2021年各月份通过一致性评价数量见图3。

图3:2020年至2021年4月份仿制药一致性评价批准数量变化情况 来源:国家药品监督管理总局
截止2021年5月6日,2021年4月FDA共批准259个510(k)途径的产品,其中一类器械8个,二类器械239个,未分类12个。2021年4月共有2个通过上市前批准(PMA)途径首次上市。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,4月产品获批类型最多的为一般和整形手术器械、骨科器械、放射科器械和心血管器械见图4。

图4:2021年4月通过FDA 510(k)途径获批上市产品类型分布情况 来源:美国食品药品监督管理局 表4:2021年4月PMA首次批准的器械

来源:美国食品药品监督管理局
截止2021年5月6日,2021年4月国家局公示了8个三类医疗器械进入创新审批绿色通道。见表5。
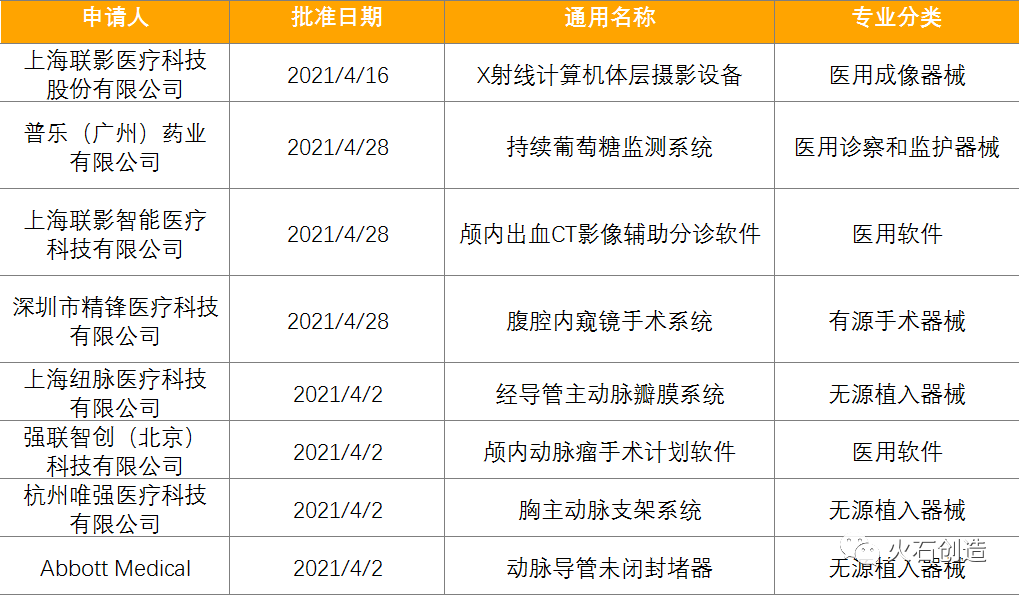
表5:2021年4月进入绿色通道的三类创新器械 来源:国家医疗器械审评中心
截止2021年5月6日,2021年4月国家局公示了3个三类创新医疗器械获批上市。见表6。
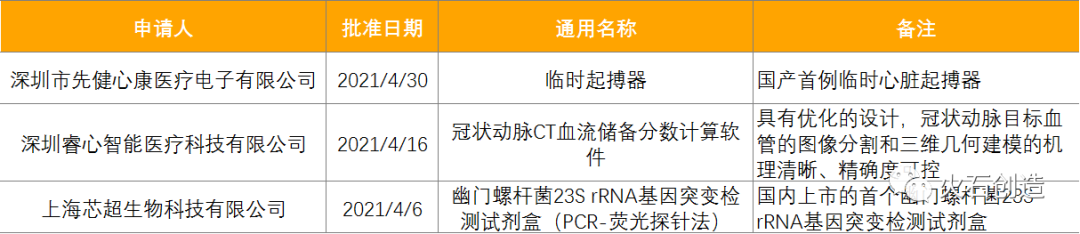
表6:2021年4月获批上市的创新医疗器械 来源:国家医疗器械审评中心
截止2021年5月6日,2021年4月国家局共批准首次注册三类医疗器械产品74个,其中国产58个,进口16个。本月各省级药品监管部门共批准境内第二类医疗器械注册943个,一类备案医疗器械1123个。 统计数据显示,体外诊断试剂数量最多,共679项,占30.9%。除体外诊断试剂外,批准注册类别排前三位的分别为注输、护理和防护器械、口腔科器械和物理治疗器械。
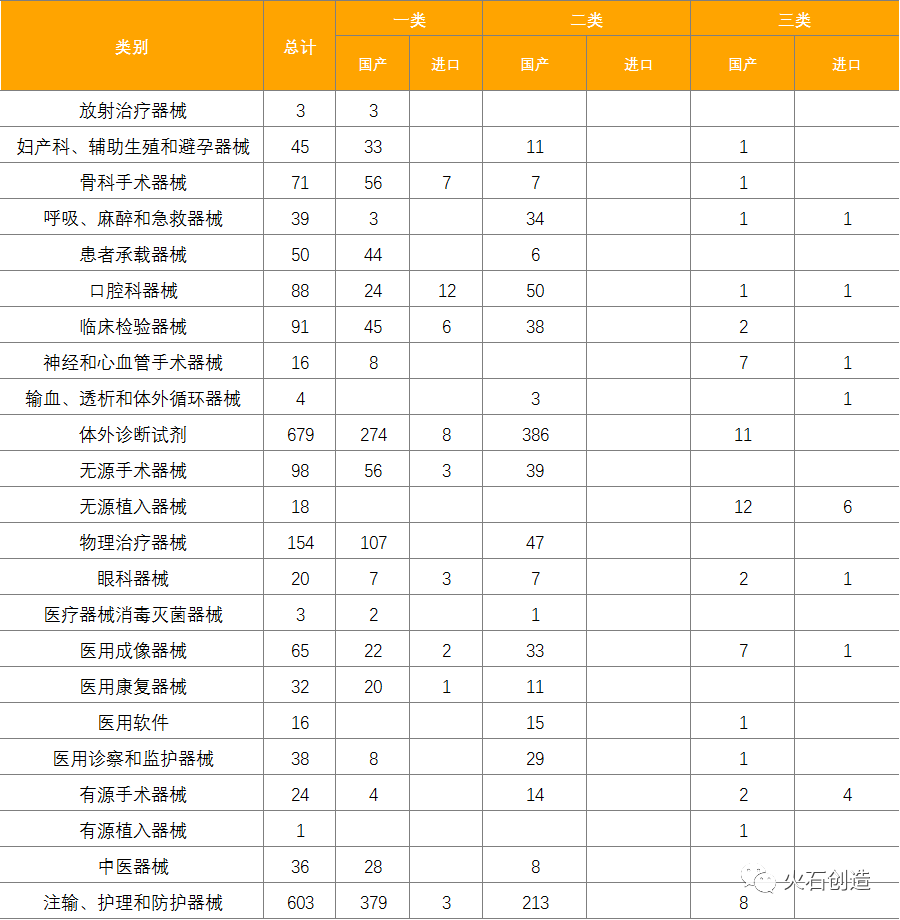
表7:2021年4月境内、进口医疗器械批准注册类别数目分布情况 来源:国家医疗器械审评中心
从地域分布上,4月境内二、三类注册产品批件最多的依次为湖南省、广东省和江苏省三个区域。见图5。
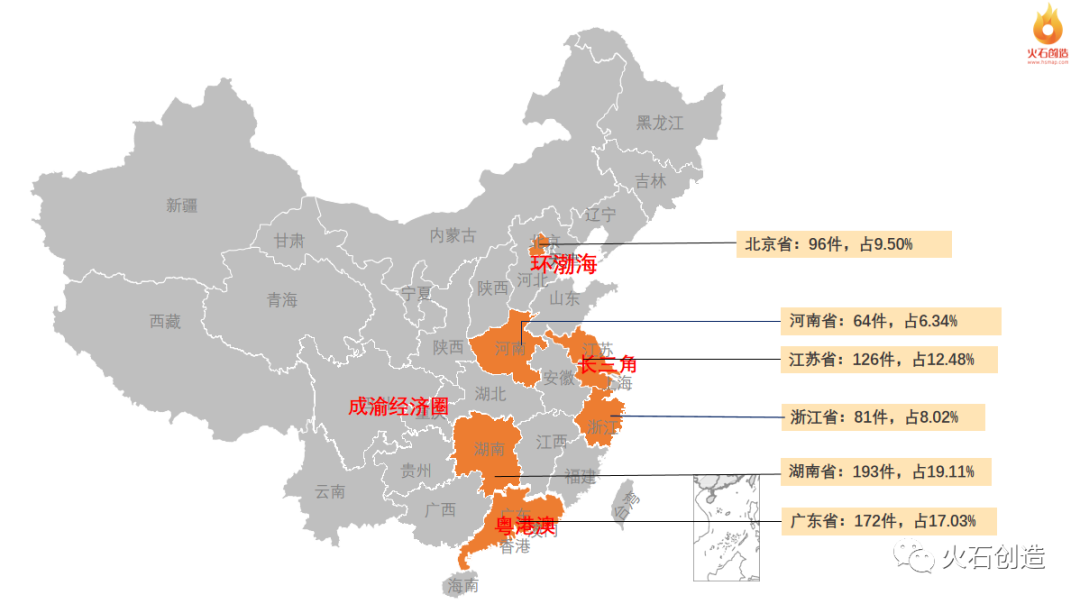
图5:境内获批器械区域分布 来源:国家医疗器械审评中心
2021年4月,全球批准新药数量有所上升,FDA共完成59项药品首次批准(不包含临时批准),其中有2个药物是新获批的新分子实体。有2款细胞疗法药物获得上市批准。EMA共批准2个新药上市,包含新活性物质1个。
国内新批准药品均为仿制药,多款重磅首仿药获批上市。仿制药一致性评价工作稳定开展,随着注射剂型一致性评价工作的开展,越来越多的注射剂将被纳入带量采购范围之内。
医疗器械方面,FDA首次批准PMA器械2个,本月国内医疗器械审批集中在体外诊断试剂,共679项获批,占30.9%。



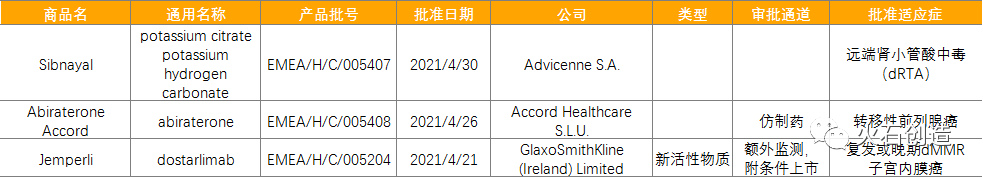
 表3:2021年04月NMPA批准首仿药物列表 来源:国家药品监督管理总局
表3:2021年04月NMPA批准首仿药物列表 来源:国家药品监督管理总局 





